Đăng bởi : CÔNG TY TNHH THƯƠNG MẠI HÓA CHẤT VÀ THIẾT BỊ HOA VIỆT 05/12/2023
1. Ammonium acetate là gì?
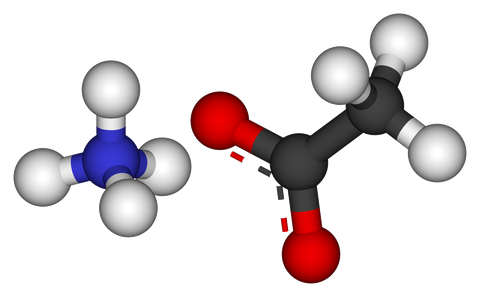
Ammonium Acetate đó là một loại muối có các đặc tính hóa học và tác dụng nên được ngành dược phẩm sử dụng làm chất trung gian và nguyên liệu trong các quy trình khác nhau.
Ammonium Acetate có tên khác là amoni axetat, acetic acid, ammonium salt - một loại muối hình thành từ phản ứng giữa amoniac và axit axetic. Nó rất hữu ích cho các ứng dụng điều chỉnh pH đệm, hoặc điều chỉnh độ chua cho thực phẩm.
Trong tự nhiên, amoni axetat không tồn tại ở trạng thái hợp chất tự do. Các ion amoni và axetat có mặt trong nhiều quá trình sinh hóa.
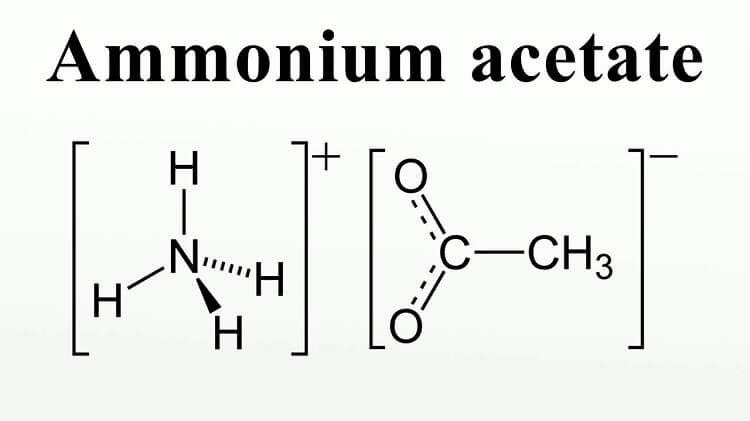
Công thức cấu tạo của Amonium acetate
2. Công thức và cấu trúc Ammonium acetate
Công thức hóa học của Ammonium Acetate là CH2COONH4. Công thức phân tử của amoni axetat là C2H6NO2 và khối lượng mol của nó là 77,08 g/mol. Ngoài ra, nó là kết hợp của ion axetat COO- (từ sự phân ly của axit axetic trong nước) và ion amoni NH4 + (từ sự phân ly của amoniac trong nước).
3. Tính chất lý hóa học của Ammonium acetate
Các tính chất vật lý và hóa học của hợp chất này như sua:
3.1. Tính chất vật lý của Ammonium acetate
Ammonium Acetate là một chất rắn màu trắng có khả năng hút ẩm, mùi hơi chua. Nhiệt độ nóng chảy của nó là 113 độ C.
Các thông số kỹ thuật về độ hòa tan khác của hợp chất bao gồm:
- Độ hòa tan trong nước:
Nó hòa tan nhiều trong nước và mật độ của nó trong chất lỏng này là 1,17g/mL -1. Độ tan trong nước của hợp chất này trong nước tăng khi nhiệt độ tăng. Lấy ví dụ: 143 g/100mL ở 20°C, 533 g/100mL ở 80°C.
- Độ hòa tan trong hợp chất khác:
Hợp chất thậm chí còn có khả năng hòa tan amoniac lỏng, axeton và rượu. Nó hòa tan ít trong metanol với độ hòa tan tương ứng là 7,89g/100mL ở 15°C và 131,24 g/100g ở 94,2°C. Độ hòa tan dimethylformamide là 0,1g/100g.

Amonium acetate là chất rắn màu trắng
3.2. Tính chất hóa học của Ammonium acetate
Ammonium Acetate là một hỗn hợp axit yếu (axit axetic) và bazơ yếu (amoniac). Vì vậy, có thể phản ứng với baze mạnh và acid mạnh như:
CH2COONH4 + HCl → CH2COOH + NH4Cl
4. Điều chế Ammonium acetate
Cũng giống như các axetat khác, chúng ta cũng có thể điều chế amoni axetat theo cách tương tự như các axetat là trung hòa axit axetic. Hơn nữa, quá trình tổng hợp này sử dụng axit axetic trung hòa bằng cách thêm amoni cacbonat.
Ngoài ra, trong công nghiệp hóa chất, phương pháp này sử dụng axit axetic băng bão hòa với amoniac:
2CH3COOH + (NH4 )2CO3 → 2CH3COONH4 + H2CO3
H2CO3 → CO2 + H2O
CH3COOH + NH3 → CH3COONH4

Điều chế Amonium acetate như thế nào?
5. Ứng dụng của Ammonium acetate
Ammonium Acetate được ứng dụng trong nhiều ngành nghề dưới đây:
- Ammonium Acetate được sử dụng làm nguyên liệu thô trong quá trình tổng hợp thuốc trừ sâu, thuốc diệt cỏ và thuốc chống viêm không steroid. Hơn nữa, nó là tiền chất trong quá trình tổng hợp acetamide (một hợp chất hóa học để sản xuất chất hóa dẻo):
CH3COONH4 → CH3C(O)NH2 + H2O
- Trong các ngành công nghiệp, CH3COONH4 sử dụng nó để axit hóa hàng dệt may, tóc nhân tạo và một số quốc gia sử dụng nó như một chất điều chỉnh độ axit thực phẩm. Với axit axetic, nó là chất đệm.
- Trong hóa học hữu cơ, amoni axetat được sử dụng làm chất xúc tác như trong các phản ứng như ngưng tụ Knoevenagel.
- Trong nông nghiệp, nó có thể sử dụng nó làm phân bón và tổng hợp chất nổ. Ngoài ra, amoni axetat còn được sử dụng làm thuốc thử, giúp xác định CEC của đất hoặc khả năng trao đổi cation cùng với lượng kali sẵn có trong đất.
- Trong nghiên cứu hóa học:
+ Nó dễ bay hơi ở áp suất thấp nên các nhà khoa học đã sử dụng nó để thay thế dung dịch đệm tế bào bằng muối không bay hơi trong việc chuẩn bị các mẫu đo khối phổ. Bên cạnh đó, nó là một bộ đệm cho các pha động để phát hiện HPLC và ELSD.
+ Trong hóa học phân tích, hợp chất ày được sử dụng ở dạng thuốc thử. Nó được sử dụng làm thuốc thử trong các quy trình lọc máu khác nhau để loại bỏ các chất gây ô nhiễm thông qua khuếch tán.
- Các ứng dụng khác như sau: Dùng để bảo quản thịt, để sản xuất nhựa vinyl.

Amonium acetate sư dụng trong tổng hợp phân bón
6. Amonium acetate có gây hại không?
Amoni axetat có thể gây kích ứng ở miệng, mắt, da và mũi. Hơn nữa, nó rất nguy hiểm khi nuốt phải và có thể gây hoại tử mô. Nó cũng có thể phá hủy màng tế bào, thâm nhập vào cơ thể sinh vật và xà phòng hóa da.Khi đun nóng, nó tạo ra khói độc có thể gây hại cho phổi. Trong vài giây, nó có thể phân hủy natri hypochlorite. Vì vậy khi sử dụng hóa chất này chúng ta cần phải cẩn thận.






Bình luận (0)
Viết bình luận :